INTRODUCCIÓN
La fermentación es un proceso
industrial que consiste en modificar la estructura química, y propiedades
intrínsecas de la leche. Varios son los derivados lácteos que se han obtenido
históricamente como leche agria, yogur, kéfir, queso, etc. Sin embargo, la
modificación de la leche cruda mediante la adición de insumos o aditivos
externos siguen en estudio y control permanente.
Algunos componentes de origen
no lácteo han sido añadidos, antes o después de la fermentación y los objetivos
han sido distintos: incrementar el valor nutricional, estudiar la viabilidad de
los cultivos iniciadores, modificar la calidad sensorial, apariencia, textura,
sabor, entre otros. Se han realizado estudios en mezclas con leche durante la
elaboración de yogurt. La naturaleza de estos ingredientes es muy amplia:
harinas de leguminosas como lenteja o arveja (Zare, 2012), garbanzo (Morales de
León et al, 2000), maní (Lee et al, 2013), té verde (Huertas, 2013) soya
germinada (Shori, 2013), extracto de Jamaica (Iwalokun, 2007), frutos secos
(Freitas, 2012) , aceites vegetales (Gad, 2010), mezclas de cereales
previamente fermentados (Coda, 2012), almidón procedente de tubérculos
(Vasconcelos, 2012), aceites marinos (Estrada et al., 2011), harina de sésamo
(Oliveira, 2011), entre otros.
Entre los ingredientes no
lácteos potencialmente utilizables también está la quinoa (Chenopodium quinoa
Willd), un cereal de consumo tradicional en los países andinos, especialmente
Perú, Bolivia y Ecuador. Según Villacrés, Peralta et al (2011), su perfil de
aminoácidos se aproxima a los recomendados por la FAO, y el contenido total de
lípidos en el grano puede llegar a un 10%. Del total lipídico, aproximadamente
60% está representado por ácidos grasos poli y mono insaturados, lo que le hace
similar al aceite de soya. La adición de quinoa en leches fermentadas es
factible partiendo de algunas formas de pretratamiento del grano, es decir,
puede incorporarse conjuntamente con la leche antes de su tratamiento térmico
para que la mezcla sea sometida al proceso de fermentación correspondiente con
los microrganismos específicos, por ejemplo, los definidos para el yogurt
Lactobacillus delbrueckii subsp. bulgaricus y Streptococcus salivarius subsp.
Thermophilus.
Lactobacillus bulgaricus (LB)
y Streptococcus thermophilus (ST) son bacterias lácticas que coexisten en una
simbiosis casi perfecta durante el procesamiento de yogurt. La relación de cada
especie fluctúa según el tiempo de fermentación y los subproductos producidos
por cada uno. Por ejemplo S. thermophilus crece más rápidamente cuando utiliza
los aminoácidos esenciales producidos por L. bulgaricus, caso contrario cuando,
S.Thermophilus produce el ácido láctico necesario para reducir el pH; beneficia
el crecimiento de L. bulgaricus. (Koutinas, 2017).
El ritmo de crecimiento de
ambas colonias de bacterias lácticas ha sido estudiada e identificada mediante
curvas de crecimiento que comprende cuatro fases: latencia (adaptación),
exponencial (de crecimiento activo), estacionaria (o máxima) y decreciente (muerte).
La adición de compuestos ajenos al yogur se ha realizado bajo la premisa de
mejorar el valor nutricional, sin embargo, se hace necesario el conocer cómo
esos aditivos influyen en el crecimiento microbiano. (Boynton and Novakovic,
2013).
MATERIALES
Y MÉTODOS
La elaboración de las
diferentes formulaciones de leche fermentada con quinoa requirió leche
semidescremada UHT comercial y harina de quinoa (Chenopodium quinoa Willd). El
grano de avena entero perteneció a la variedad INIAP Tunkahuan, procedente del
Centro Experimental Santa Catalina del Instituto de Investigaciones
Agropecuarias del Ecuador (INIAP). La quinoa fue transformada en harina a
partir de 3 tipos de grano: lavado, cocido y tostado.
La muestra control fue la
leche UHT semi descremada comercial sin adición de harina de quinoa. Se utilizó
0,05 g de cultivo, formado por Lactobacillus delbrueckii subsp. bulgaricus y
Streptococcus salivarius subsp. Thermophilus (YC-11 de la marca comercial Chr.
Hansen) y se incubaron a 42⁰C hasta alcanzar un pH de 4,6 en un baño
maría marca Memmert. Finalizado el proceso de fermentación, se realizó una
mezcla mecánica por 30 segundos para posteriormente almacenar las leches con el
cultivo en frascos de plástico previamente esterilizados y refrigerados entre 4
a 5⁰ C para los análisis durante el tiempo de almacenamiento.
Posteriormente se tomaron
muestras por duplicado durante los días 1, 7, 14 y 21 de almacenamiento según
las especificaciones de la norma (INEN:009-2012). La siembra y recuento se
realizaron de acuerdo a lo indicado por Gamazo, López et al (2009) y Ahmed &
Carlstrom (2006). Se realizaron diluciones sucesivas en agua peptonada
tamponada estéril y siembras por profundidad en placas con Agar Man Rogosa y
Sharpe (MRS) para Lactobacillus previamente fundido y temperado a 40⁰C.
Las placas fueron incubadas en condiciones de anaerobiosis a 30⁰C por 48
horas.
Los datos recopilados fueron
extraídos mediante el procedimiento PRT-712.02-047 del Procedimiento “recuento
de cultivos iniciadores del yogur del Instituto de Salud Pública de Chile”. De
tal manera que se generaron datos al respecto de Lactobacillus y Streptococcus;
con tres tipos de sustrato: leche cruda comercial (0), leche con harina de
quinoa lavada (L), leche con harina de quinoa cocida (C) y finalmente leche con
harina de quinoa tostada (T), estas tres últimas al 2,5% de concentración. Tal
como indica el procedimiento utilizado, se tomaron muestras de los días 1, 7,
14, 21 de 2 lotes, con 2 réplicas cada uno.
De esta manera, la presente
investigación posee:
|
P
|
t
|
R
|
código
|
|
0
|
1
|
1
|
(0-1-1)
|
|
0
|
1
|
2
|
(0-1-2)
|
|
0
|
2
|
1
|
(0-2-1)
|
|
0
|
2
|
2
|
(0-2-2)
|
|
L
|
1
|
1
|
(L-1-1)
|
|
L
|
1
|
2
|
(L-1-2)
|
|
L
|
2
|
1
|
(L-2-1)
|
|
L
|
2
|
2
|
(L-2-2)
|
|
C
|
1
|
1
|
(C-1-1)
|
|
C
|
1
|
2
|
(C-1-2)
|
|
C
|
2
|
1
|
(C-2-1)
|
|
C
|
2
|
2
|
(C-2-2)
|
|
T
|
1
|
1
|
(T-1-1)
|
|
T
|
1
|
2
|
(T-1-2)
|
|
T
|
2
|
1
|
(T-2-1)
|
|
T
|
2
|
2
|
(T-2-2)
|
Tabla 1. Identificación
de las muestras.
Así por ejemplo la combinación (C-2-2) hace
referencia a la leche enriquecida con harina de quinoa cocida correspondiente
al segundo lote y segunda réplica de medición.
RESULTADOS
Y DISCUSIÓN
Se analizaron dos
microorganismos: Lactobacillus bulgaricus y Streptococcus thermophylus. La
calidad del yogur no sólo se la identifica en pH o sabor, sino también por la
colonia bacteriana “benéfica'' presente en el mismo. Después de los resultados
obtenidos; a continuación, se detallan la presencia de los microorganismos a lo
largo del período de almacenamiento del yogur.
Lactobacillus
Leche
semidescremada comercial (0)
Para
este análisis se consideraron las muestras sin ningún aditivo (0); los dos lotes
(1), (2) y ambas réplicas (1) y (2). Se ha establecido la función real a lo
largo del tiempo de almacenamiento del yogur y presentados en tablas y
gráficos, como sigue (P: pretratamiento, t: tiempo, lote, R: réplica, UFC:
unidades formadoras de colonias)
|
P
|
t
|
lote
|
R
|
log
(UFC)
|
|
0
|
1
|
1
|
2
|
4.45
|
|
0
|
7
|
1
|
2
|
4.59
|
|
0
|
14
|
1
|
2
|
5.31
|
|
0
|
21
|
1
|
2
|
6.08
|
Tabla 2. Datos (0-1-2).
Se
añade una columna obtenida por 10log UFC para obtener el valor real
de colonias formadas.
|
P
|
t
|
lote
|
R
|
log
(UFC)
|
Exp
|
|
0
|
1
|
1
|
2
|
4.45
|
28173
|
|
0
|
7
|
1
|
2
|
4.59
|
38800
|
|
0
|
14
|
1
|
2
|
5.31
|
206767
|
|
0
|
21
|
1
|
2
|
6.08
|
1200000
|
Tabla 3. (0-1-2).
Con
la ayuda de un software matemático se obtiene la gráfica y la función
correspondiente.
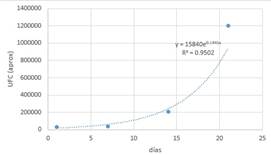
Figura 1. Lactobacillus en almacenamiento en leche semidescremada UHT.
La curva
corresponde al crecimiento exponencial de un microorganismo y que viene
definida por la función:
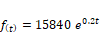
Leche
con harina de quinoa lavada (L)
Para
los datos con harina de quinoa lavada (L), se obtiene
|
P
|
t
|
lote
|
R
|
log
(UFC)
|
Exp
|
|
L
|
1
|
1
|
2
|
4.35
|
22387
|
|
L
|
7
|
1
|
2
|
4.71
|
51286
|
|
L
|
14
|
1
|
2
|
5.43
|
269153
|
Tabla 4. Datos (L-1-2).
Con
la ayuda de un software matemático se obtiene la gráfica y la función
correspondiente.
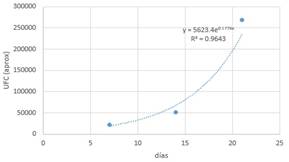
Figura 2. Lactobacillus en almacenamiento con medio L.
La
curva corresponde al crecimiento exponencial de un microorganismo y que viene
definida por la función:
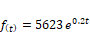
Leche
con harina de quinoa cocida (C)
Para
los datos de concentración al 2,5% en peso de harina de quinoa cocida (C), se
obtiene:
|
P
|
t
|
lote
|
R
|
log
(UFC)
|
Exp
|
|
C
|
1
|
1
|
1
|
4.02
|
10471
|
|
C
|
7
|
1
|
1
|
3.75
|
5623
|
|
C
|
14
|
1
|
1
|
5.08
|
150226
|
|
C
|
21
|
1
|
1
|
5.53
|
338844
|
Tabla 5. Datos (C-1-2).
Con
la ayuda de un software matemático se obtiene la gráfica y la función
correspondiente.
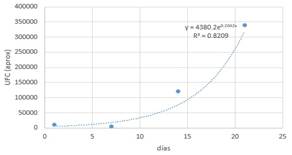
Figura 3. Lactobacillus en almacenamiento con medio C
La
curva corresponde al crecimiento exponencial de un microorganismo y que viene
definida por la función:
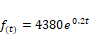
Leche
con harina de quinoa tostada (T)
Para
los datos de concentración al 2,5% en peso de harina de quinoa cocida (T), se
obtiene:
|
P
|
t
|
lote
|
R
|
log
(UFC)
|
Exp
|
|
T
|
1
|
1
|
2
|
3.60
|
3981
|
|
T
|
7
|
1
|
2
|
4.25
|
17783
|
|
T
|
14
|
1
|
2
|
5.12
|
131826
|
|
T
|
21
|
1
|
2
|
5.81
|
645654
|
Tabla 6. Datos (T-1-2).
Con
la ayuda de un software matemático se obtiene la gráfica y la función
correspondiente.
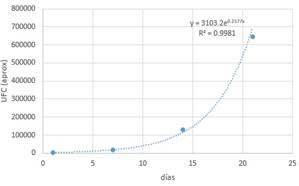
Figura 4. Lactobacillus en
almacenamiento con medio T.
La
curva corresponde al crecimiento exponencial de un microorganismo y que viene
definida por la función:
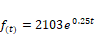
Streptococcus
Leche
semidescremada comercial (0)
En
esta ocasión se consideraron las muestras sin ningún aditivo (0); los lotes
(1), (2) y ambas réplicas (1) y (2) Se ha establecido la función real a lo
largo del tiempo de almacenamiento del yogur y presentados en tablas y
gráficos, como sigue: (P: pretratamiento, t: tiempo, R: réplica, UFC: unidades
formadoras de colonias.
|
P
|
t
|
lote
|
R
|
log
(UFC)
|
|
0
|
1
|
1
|
2
|
3.08
|
|
0
|
7
|
1
|
2
|
4.71
|
|
0
|
14
|
1
|
2
|
4.95
|
|
0
|
21
|
1
|
2
|
6.48
|
Tabla 7. Datos originales (0-1-2).
Se
añade una columna obtenida por 10log UFC para obtener el valor real
de colonias formadas.
|
P
|
t
|
lote
|
R
|
log
(UFC)
|
Exp
|
|
0
|
1
|
1
|
2
|
3.08
|
4753
|
|
0
|
7
|
1
|
2
|
4.71
|
51133
|
|
0
|
14
|
1
|
2
|
4.95
|
89000
|
|
0
|
21
|
1
|
2
|
6.48
|
300000
|
Tabla 8. Datos (0-1-2).
Con
la ayuda de un software matemático se obtiene la gráfica y la función
correspondiente.
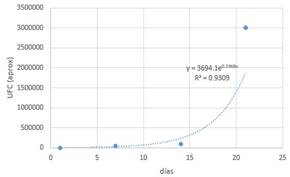
Figura 5. Streptococcus en
almacenamiento con medio 0.
La
curva corresponde al crecimiento exponencial de un microorganismo y que viene definida
por la función:
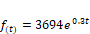
Leche
con harina de quinoa lavada (L)
Para
los datos con harina de quinoa lavada (L), se obtiene:
|
P
|
t
|
lote
|
R
|
log
(UFC)
|
Exp
|
|
L
|
1
|
1
|
2
|
3.72
|
5248
|
|
L
|
7
|
1
|
2
|
4.98
|
95499
|
|
L
|
14
|
1
|
2
|
5.20
|
158489
|
|
L
|
21
|
1
|
2
|
5.76
|
575440
|
Tabla 9. Datos (L-1-2).
Con la ayuda de un software matemático se
obtiene la gráfica y la función correspondiente.
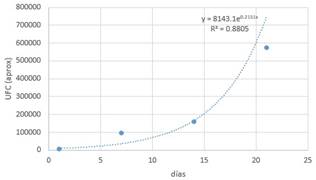
Figura 6.
Streptococcus en almacenamiento con medio L.
La curva corresponde al crecimiento
exponencial de un microorganismo y que viene definida por la función:
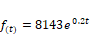
Leche con harina de quinoa cocida (C)
Para los datos de concentración al 2,5% en
peso de harina de quinoa cocida (C), se obtiene:
|
P
|
t
|
lote
|
R
|
log
(UFC)
|
Exp
|
|
C
|
1
|
1
|
1
|
4.23
|
16982
|
|
C
|
7
|
1
|
1
|
4.30
|
19953
|
|
C
|
14
|
1
|
1
|
5.71
|
512861
|
|
C
|
21
|
1
|
1
|
5.86
|
724436
|
Tabla 10. Datos (C-1-1).
Con la ayuda de un software matemático se
obtiene la gráfica y la función correspondiente.
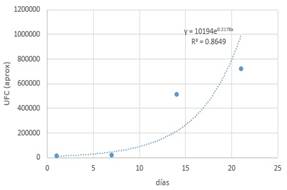
Figura 7.
Streptococcus en almacenamiento con medio C.
La curva corresponde al crecimiento
exponencial de un microorganismo y que viene definida por la función:
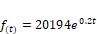
Leche con harina de quinoa tostada (T)
Para los datos de concentración al 2,5% en
peso de harina de quinoa cocida (T), se obtiene:
|
P
|
t
|
lote
|
R
|
log
(UFC)
|
Exp
|
|
T
|
1
|
1
|
2
|
3.86
|
7244
|
|
T
|
7
|
1
|
2
|
4.58
|
38019
|
|
T
|
14
|
1
|
2
|
5.72
|
524807
|
|
T
|
21
|
1
|
2
|
6.29
|
1949845
|
Tabla 11.
Datos (T-1-2).
Con la ayuda de un software matemático se
obtiene la gráfica y la función correspondiente.
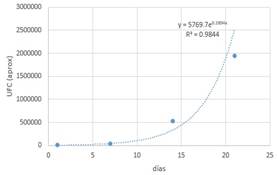
Figura 8.
Streptococcus en almacenamiento con medio T.
La curva corresponde al crecimiento
exponencial de un microorganismo y que viene definida por la función:
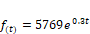
CONCLUSIONES
Luego de realizar la comparación de los 4
tipos de leches, se evidenció que la presencia de harina de quinoa en
cualquiera de sus tratamientos previos no superó la población del yogur
control, tanto en Lactobacilus como en Streptococcus al día 21 durante el
almacenamiento del yogur. Realizando la comparación de las leches fermentadas
con harina de quinoa en todos sus tratamientos, se evidencia que la HQT alcanzó
la mayor población respecto a HQC y HQL, al día 21 de almacenamiento.
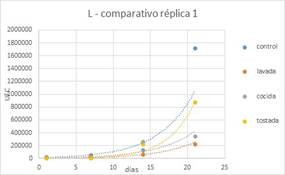
Figura 9. Lactobacillus en almacenamiento de réplica 1.
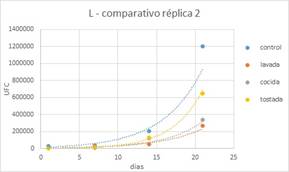
Figura 10.
Lactobacillus en almacenamiento de réplica 2.
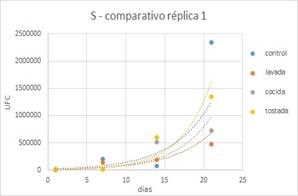
Figura 11.
Streptococcus en almacenamiento de réplica 2.
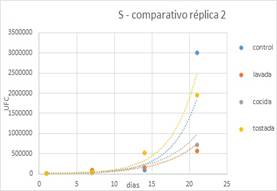
Figura 12. Streptococcus en almacenamiento de réplica 2.
Es de suma importancia la relación
simbiótica que existe entre Lactobacillus y Streptococcus durante el
almacenamiento; en el caso de la presente investigación se obtuvieron las
siguientes relaciones 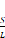
|
día
|
0
|
L
|
C
|
T
|
|
(control)
|
(lavada)
|
(cocida)
|
(tostada)
|
|
1
|
0.8
|
2.3
|
1.3
|
2.8
|
|
7
|
3.9
|
4.4
|
2.2
|
3.3
|
|
14
|
0.6
|
3.4
|
2.0
|
2.8
|
|
21
|
1.4
|
2.1
|
2.1
|
1.5
|
Tabla 12. Relación 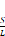
La digestibilidad de las proteínas de la
leche es muy cercana al 100% al contrario las proteínas de la quinoa que al ser
un cereal su digestibilidad bordea el 80%. El tratamiento térmico (cocción)
mejora la digestibilidad de las proteínas de la quinoa enriqueciendo al
alimento añadido, en este caso el yogur.
El proceso térmico al cual ha sido sometida
la quinoa antes de añadirse a la leche genera el enriquecimiento de la leche en
aminoácidos tales como arginina (7,11%) que al parecer no influye en el
incremento de la población de cultivos iniciadores durante el almacenamiento
del yogur.
Durante la investigación se identificó que
en las leches enriquecidas con harina de quinoa en cualquier presentación; la
mayor población microbiana se obtuvo en la leche enriquecida con harina de
quinoa tostada, debido a que la quinoa al ser sometida a un tratamiento térmico
seco, la disponibilidad de lisina se ve disminuida.
Siguiendo este análisis la menor población
microbiana se obtuvo en la leche enriquecida con harina de quinoa lavada.
Debido a que la quinoa al no ser sometida a un ningún tratamiento térmico, sino
únicamente a un lavado con agua común, exclusivamente fueron extraídas las
saponinas que es un glucósido vegetal; dejando a la lisina disponible inhiba
aún más el crecimiento microbiano.
La comparación entre las poblaciones LB
(Lactobacillus bulgaricus) y ST (Streptococcus thermophilus) durante el
almacenamiento es un indicador importante para conocer que el sustrato en este
caso, la leche enriquecida brinda el medio idóneo para el desarrollo de ambas
bacterias lácticas. En el presente estudio se establece que la relación ST:LB
se encuentra entre 1,06 y 1,14; dato que se acerca bastante al ideal que es de
1:1. Sin embargo es recomendable ahondar en futuros estudios con leches
enriquecidas para determinar relación poblacional mayores a ST:LB de 1:1, 2:1 o
3:2, especialmente al inicio del almacenamiento que puede ser definida como una
relación de crecimiento benéfica.
CONTRIBUCIÓN
DE LOS AUTORES
El artículo que se pone a
revisión es de autoría de Roberto Daniel Calderón Valle.
AGRADECIMIENTOS
Especial agradecimiento a la
Universidad Tecnológica Equinoccial (UTE) por el apoyo a la investigación
referente a materiales y equipos utilizados para la elaboración del artículo.
REFERENCIAS
BIBLIOGRÁFICAS
INIAP (Estación experimental Santa
Catalina, Departamento de nutrición y calidad de los alimentos, EC) 2011.
Potencial Agroindustrial de la Quinoa. Boletin Divulgativo No. 146.
Koutinas, A, 2007. Fermented dairy products. Current developments in biotechnology and
bioengineering (pp. 3-24)
Villacrés, Peralta et al
2013. Potencial agroindustrial de la quinoa. Instituto Nacional de
Investigaciones Agropecuarios. INIAP
Gamazo, López et al
(2009). Manual práctico de Microbiología. Editorial Elsevier. Barcelona, España.
Boyton, R., Novakovic, A, (013. Industry evaluations of the status
and prospects for the burgeoning, Program on Dairy Markets and Policy Research
Paper Series RP13-01, 1-52. New York, USA.
Coda, R, et al., 2012.
Yogurt-like beverages made of a mixture of cereals, soy and grape must:
microbiology, texture, nutritional and sensory properties. International
Journal of Food Microbiology, 155(3), 120-127.New York, USA
De Oliveira Finco., A
Cordova K, 2011. Elaboracao de iogurte com adicao de farinha de gergelim
Yogurt-making with addition of sesame flour. Ambiencia.
Matto Grosso, Brasil
De Oliveira Finco, A
2014. Fermented Milks. Editorial Totorello.
Encyclopedia of food microbiology (second edition) (pp. 908-922). Oxford, UK.
Estrada, J et al},
2011. Developing a strawberry yogurt fortified with marine fish oil. Journal of dairy science, 94(12), 5760-5769.
Huertas. 2013. Efecto del
té verde (Camellia sinensis L) en las características fisicoquímicas,
microbiológicas, proximales y sensoriales de yogurt durante el almacenamiento
bajo refrigeración. Ciencia y Tecnología Alimentaria,
11 (1).
Iwalokun, B., Shittu
M, 2007. Effect of Hibiscus sabdariffa (calyce) extract on biochemical and
organoleptic properties of yogurt. Journal of Nutrition, 6(2), 172-182.
Pakistán.
Lee, Y., Al Mijan, M,
2013. The physicochemical properties of yoghurt supplemented with
microencapsulated peanut sprout extract, a possible functional ingredient. International Journal of Dairy Technology 66(3): 417-423
Morales de León, J.,
Cortés Penedo, E, 2000. Elaboración de un yogurt con base en una mezcla de
leche y garbanzo (Cicer arietinum). Arch. latinoam.
nutr, 50(1), 81-6.
Seo, M., Lee, S, 2000.
Physicochemical, microbial, and sensory properties of yogurt supplemented with
nanopowdered chitosan during storage. Journal of dairy science 92(12):
5907-5916.
Shori, A.,Baba, A},
2012. Viability of lactic acid bacteria and sensory evaluation in Cinnamomum
verum and Allium sativum-bio-yogurts made from camel and cow milk. Journal of
the Association of Arab Universities for Basic and Applied Sciences, 11(1), 50-55.
Vascocellos, C;
Chaves, J, 2012. Low-calorie yogurt added with yacon flour: development and
physicochemical evaluation. Revista Chilena de Nutrición, 39(3), 65-71.
Zare, C; Boye, J,
2012. Growth of starter microorganisms and acidification trend in yogurt and
probiotic media supplemented with pulse ingredients. LWT-Food
Science and Technology, 45, 155-160
Burbano, H. 2015. Calidad proteica del
cultivo de quinoa. Reunión Binacional sobre planificación de la producción.
Freitas, M., Moura., L, 2012.
Elaboracñao de iogurte com adicao de castanha de caju e avaliaco da sua
aceitaco sensorial 1, In VII CONNEPI-Congresso Norte Nordeste de Pesquisa e
Inovacao. Matto Grosso, Brasil
Gad, A et al, 2010
Evaluation of the nutritional value of functional yoghurt resulting from a
combination of date palm syrup and skim milk. IV International Date Palm
Conference 882.